Нахождение в природе водорода, минералы водорода




В природе водород практически всегда связан с другими элементами, чаще всего с кислородом (например, в воде) и углеродом (в органических соединениях). В виде соединений с углеродом водород входит в состав нефти, природных газов, всех живых организмов. Свободный водород встречается в небольших количествах в вулканических газах, но легкий газ быстро покидает атмосферу, уходя в космическое пространство.
Вода – удивительный минерал на нашей планете. Она находится в непрерывном движении, управляет климатом Земли, формирует рельеф суши. В то же время вода – это самый распространенный минерал на поверхности Земли, образованный кислородом и водородом. Гидросфера – водная оболочка планеты – занимает 71% поверхности. Как известно, вода входит в состав минералов, горных пород, всех живых организмов.
Состав воды
В связи с существованием изотопов водорода (H, D, T) и кислорода (16O, 17O, 18O) известно несколько изотопных разновидностей воды. Наиболее распространенные из них существуют в природе в следующих соотношениях: а) 99,73% H216O и 0,2% H218O; б) 0,03% HD16O и 0,04% H217O.
Особый интерес представляет тяжелая вода D2O, впервые выделенная из природной воды в 1932 г. Присутствие в составе молекул атомов дейтерия существенно сказывается на свойствах вещества. Последние в значительной степени отличаются от свойств обыкновенной воды. Так, у тяжелой воды tкип.=101,43°С, tпл.=3,82°С, плотность равна 1,104 г/см3. На живые организмы даже небольшие количества тяжелой воды действуют угнетающе.
По химическим свойствам тяжелая вода близка к обычной. Количество природной тяжелой воды невелико (0,02% от общей массы воды). В составе вод Земли содержится и сверхтяжелая вода, имеющая в своем составе тритий. Этого экзотического вещества на планете всего 13 – 20 кг.
Строение молекулы воды
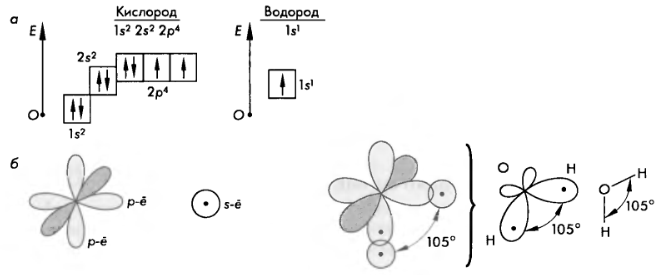
Схема строения электронных оболочек атомов кислорода и водорода (а).
Образование связей в молекулах воды (б)
Обе связи O – H в молекуле воды – ковалентные, полярные равноценные. В то же время заряды в молекуле воды распределяются таким образом, что формируются две противоположно заряженные области, которые находятся на некотором расстоянии друг от друга.
Угловое строение молекулы воды, а также наличие в ней противоположно заряженных центров приводят к возникновению так называемых водородных связей. Отрицательно заряженный атом кислорода одной молекулы притягивается к положительно заряженному атому водорода другой молекулы, и наоборот. Таким образом возникает межмолекулярное взаимодействие:
Молекулы воды оказываются ассоциированными (объединенными) посредством водородных связей.
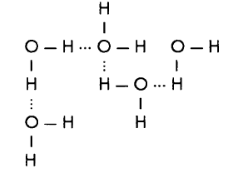
В единый комплекс объединяется по 5-7 молекул воды. Такое объединение ведет к укрупнению частиц вещества, что и обусловливает физические свойства воды: tпл. = 0°С, tкип. = 100°С (при атмосферном давлении), ρ = 0.9982 г/см3 при 20°С, т.е. самую высокую теплоемкость среди жидкостей (4,184 кДж/моль).
Итак, молекула воды полярна (диполь). Этим объясняется ее универсальная способность к растворению всех веществ, имеющих полярное строение. В воде растворяются оксиды, кислоты, соли, щелочи – вещества, для которых характерна ионная или полярная ковалентная связь.
Химические свойства воды
1. Взаимодействие воды с металлами. Эти реакции относятся к окислительно-восстановительным. При комнатной температуре с водой реагируют лишь наиболее активные – щелочные и щелочноземельные металлы:
2Na + 2H2O → 2NaOH + H2↑
Mg + H2O 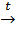 MgO + H2↑
MgO + H2↑
3Fe + 4H2O 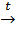 Fe3O4 + 4H2↑
Fe3O4 + 4H2↑
2. Вода взаимодействует с растворимыми кислотными оксидами с образованием соответствующих кислот:
3H2O + P2O5 → 2H3PO4
H2O + SO2 → H2SO3
3. При взаимодействии воды с оксидами щелочных и щелочноземельных металлов образуются растворимые или малорастворимые в воде основания:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Источники
1. http://dimamp.com/ngg_tag/water/
2. http://journal-shkolniku.ru/nevidimki.html
4. http://www.fotokonkurs.ru/photo/38439
5. Кузнецова, Н. Е. Химия: 8 класс. Учебник для учащихся общеобразовательных учреждений / Н. Е. Кузнецова, И. М. Титова, Н. Н. Гара, А. Ю. Жегин // М.: Вентана-Граф, 2008.
6. Леенсон, И. А. Путеводитель по химическим элементам. Из чего состоит Вселенная? / И. А. Леенсон // М. : АСТ, 2014. – 168 с.: ил.